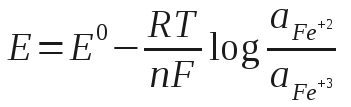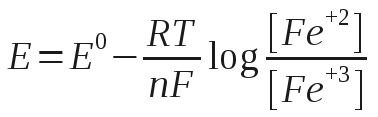Podemos considerar um marco histórico importante na ligação entre química e eletricidade a descoberta de Allesandro Volta (1793) de que a eletricidade poderia ser produzida pela colocação de dois metais diferentes em lados opostos de um papel humedecido. Mas talvez essa ligação pode ser ainda mais antiga! (Ver A Pilha de Bagdá).
Em 1800, Nicholson e Carlisle, usando como fonte de eletricidade a bateria de Volta mostraram que uma corrente elétrica poderia decompor a água em oxigênio e hidrogênio. Esta foi certamente uma das experiências mais significativas na história da química, ao mostrar que os átomos de hidrogênio e oxigênio estavam associados pela ação de forças de natureza elétrica.
Em 1812, o químico sueco Berzelius propôs que todos os átomos são eletrificados, hidrogênio e os metais seriam positivo, os não-metais seriam negativos. Na eletrólise, a tensão elétrica aplicada seria capaz de suplantar a atração entre essas cargas opostas, separando os átomos eletrificados uns dos outros na forma de “íons” (nome escolhido por Berzelius a partir do Grego significando “viajantes”).
Aproximadamente cem anos mais tarde esse modelo de ligação química foi aperfeiçoado pela teoria de compartilhamento de elétrons de Lewis. (Fonte: www.chem1.com/acad/webtext/elchem/ec1.html)
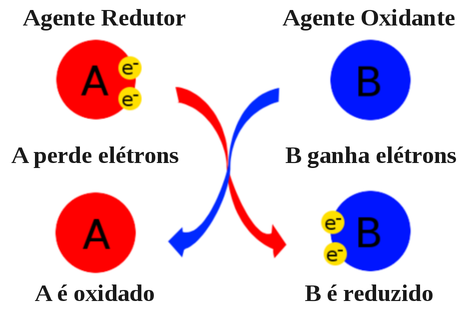
As reações de oxiredução, também conhecidas por “redox” ou reações “eletroquímicas” envolvem a transferência de elétrons entre os reagentes. Na oxidação ocorre perda de elétrons enquanto que na redução ocorre o ganho de elétrons.
Quando uma substância perde elétrons se diz que ela sofreu uma oxidação e ao ganhar elétrons sofreu uma redução.
Nota
Não existe um processo de oxidação isolado, ou seja, para uma espécie se oxidar (perder elétrons) deve existir uma outra espécie que sofra redução (ganhar elétrons).
A substância que doa elétrons é classificada como o agente redutor enquanto que a espécie que recebe os elétrons é chamada de agente oxidante.
E o número total de elétrons fornecidos pelo redutor deve ser igual ao número de elétrons recebidos pelo oxidante.
O cloro é um oxidante (B) que ganha elétrons ao oxidar um contaminante (A) e é reduzido a cloreto, enquanto que o contaminante (A) perde elétrons e é oxidado.
Mas por que as reações redox acontecem?
Vamos usar como analogia dois vasos comunicantes (A e B) em diferentes níveis.
Figura D.2. Diagrama esquemático de um “par redox” A (redutor) e B (oxidante). (Fonte: http://bouman.chem.georgetown.edu/S02/lect25/lect25.htm)
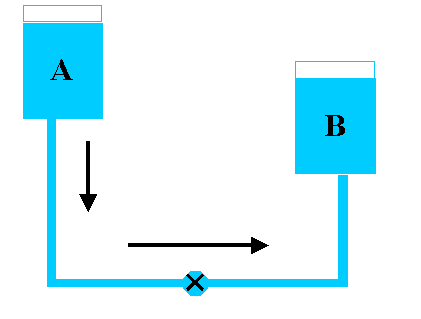
No diagrama da figura D.2, quando a válvula é aberta o líquido do reservatório A fluirá para o reservatório B porque A possui uma “energia potencial gravitacional” maior. Podemos imaginar, por analogia, que o líquido representa os elétrons e nesse caso A será um redutor e B um oxidante, e a reação também irá ocorrer pela diferença de “energia potencial” mas nesse caso um “potencial químico”.
As reações redox são aquelas onde ocorrem mudanças no estado de oxidação dos reagentes, através da troca de elétrons entre as espécies.
Nota
O estado de oxidação é uma “carga fictícia” que se atribui aos átomos ou íons em um molécula através de algumas “regrinhas”.
Ou seja, o estado de oxidação é uma “abstração” química, mas que é muito útil para cálculos de estequimometria (balanceamento de reações redox) e na química descritiva. (Fonte: Introduction to Solid State Chemistry | edX)
Regras para atribuição do estado de oxidação:
O estado de oxidação de uma substância monoatômica é igual à carga eletrônica
Em um composto covalente, o estado de oxidação de cada átomo é a carga restante no átomo quando o par de elétrons, compartilhado na ligação covalente, é atribuído completamente para o átomo mais eletronegativo. Um par de elétrons compartilhado entre dois átomos com a mesma eletronegatividade é dividido entre ambos os átomos da ligação.
A soma dos estados de oxidação dos átomos que formam uma molécula é zero. E a soma dos estados de oxidação dos átomos que formam um íon é igual à carga formal do íon.
Fonte: Aquatic chemistry, 1996
Para um condutor metálico imerso em uma solução de um eletrólito, todo excesso de carga reside na sua superfície, e é possível ajustar a densidade de carga nessa superfície ajustando a saída de uma fonte externa de energia ligada ao condutor.
À medida que a fonte externa força os elétrons para a superfície de um eletrodo, os elétrons acumulam-se em uma região e a energia aumenta devido à repulsão coulombiana, o que resulta em um aumento do potencial negativo. Este potencial negativo pode atingir um valor tal que, dependendo da composição da solução, os elétrons da superfície do eletrodo sejam transferidos para os íons presentes na solução iniciando uma reação de redução.
Mas se o circuito externo retira elétrons do eletrodo a superfície terá carga positiva e se desenvolverá um potencial positivo. E da mesma forma, o potencial positivo pode atingir um valor tal que, dependendo da composição do condutor, os átomos do eletrodo liberem elétrons para o circuito e passem para a solução na forma de cátions, sofrendo uma reação de oxidação. Ou os íons da solução podem transferir elétrons para o eletrodo condutor (Ex: 2OH- → O2 + 4e- + 2H+).
Esses são os processos envolvidos em uma célula eletrolítica.
Mas também é possível variar a energia dos elétrons na superfície do condutor, e consequentemente o potencial de um eletrodo metálico, variando-se a composição da solução na qual o condutor está imerso. Por exemplo, considere um eletrodo de platina imerso em uma solução contendo Fe+2 e Fe+3 no equilíbrio: Fe+3 + e- → Fe+2.
Se a concentração de Fe+2 for maior do que a de Fe+3 haverá a tendência do Fe+2 doar elétrons para o metal causando uma acumulação de carga negativa na superfície do metal e consequentemente gerando um potencial negativo no eletrodo de platina.
Por outro lado, se a concentração de Fe+3 for maior do que a de Fe+2 haverá uma tendência de remoção de elétrons da superfície do metal, gerando uma carga positiva na superfície do eletrodo e consequentemente um potencial positivo no eletrodo de platina.
Agora imagine uma solução contendo íons Fe+2 e Fe+3 suficientemente ácida para evitar a precipitação de Fe(OH)3. E suponha que esta solução seja tratada com hidrogênio gasoso, adsorvido em um catalisador, platina por exemplo. A reação global que irá ocorrer, pode ser descrita por:
Esta reação é a soma de duas semi-reações, uma semi-reação de redução do íon Fe+3,
e uma semi-reação onde o hidrogênio é oxidado:
Quando as duas semi-reações (D.2 e D.3) são somadas algebricamente os elétrons se cancelam e o resultado é a reação global D.1.
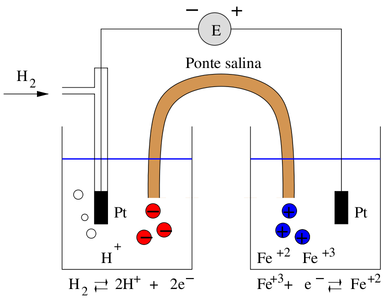
Para visualizar as duas semi-reações, considere que as duas reações sejam separadas em uma cela eletroquímica,como mostra a figura D.3.
Uma célula eletroquímica cc consiste de dois condutores elétricos chamados de eletrodos, imersos em soluções apropriadas de eletrólitos. Para que surja uma corrente em uma célula é necessário que:
os eletrodos estejam conectados externamente por meio de um condutor metálico,
as duas soluções de eletrólito estejam em contato para permitir o movimento de íons entre as meia-células,
uma reação de transferência de elétrons possa ocorrer em cada um dos eletrodos.
As duas soluções estão ligadas por uma ponte salina que consiste em um tubo cheio de uma solução que é saturada com cloreto de potássio ou algum outro eletrólito. As duas extremidades do tubo são dotadas de terminais porosos que permitem o movimento de íons através deles mas impedem que o líquido seja sifonado de uma solução de eletrólito para outra.
A finalidade da ponte salina é isolar o conteúdo das duas meia-células enquanto mantém o contato elétrico entre elas, evitando dessa forma a reação direta dos íons de uma meia-célula com o eletrodo da outra meia-célula.
A ponte salina permite a migração de íons entre os dois compartimentos para manter a eletroneutralidade entre as duas células. Veja mais informações sobre ponte salina nos links: https://www.youtube.com/watch?v=eP-3J_RwLkY e http://chemwiki.ucdavis.edu.
A carga elétrica é conduzida por três processos distintos nas várias partes da célula mostrada na figura D.3:
Nos eletrodos de platina, assim como no condutor externo, os elétrons atuam como transportadores movendo-se a partir da célula da esquerda (hidrogênio adsorvido), onde ocorre a oxidação (ânodo) do hidrogênio, para a célula da direita, onde ocorre a redução (cátodo) do Fe+3.
Dentro das soluções ocorre a migração de cátions e ânions. Na meia-célula da esquerda os cátions H+ migram para longe do eletrodo enquanto que os ânions cloreto se aproximam do eletrodo. Na meia-célula da direita o Fe+3 se aproxima do eletrodo de platina e os ânions se afastam dele. Dentro da ponte salina a eletricidade é conduzida pela migração dos íons potássio para a direita e os íons cloreto para a esquerda. Dessa forma todos os íons das três soluções participam do fluxo de eletricidade.
E na superfície dos eletrodos de platina ocorre uma reação de oxidação (meia-célula da esquerda) e de redução (meia-célula da direita). Esse processo redox faz o acoplamento da condução de íons na solução com a condução eletrônica no eletrodo permitindo fechar o circuito para o fluxo de cargas.
Por definição, o cátodo de uma célula eletroquímica é o eletrodo no qual ocorre a redução e o ânodo é o eletrodo no qual ocorre a oxidação. Essas definições se aplicam tanto a células galvânicas como eletrolíticas.
Podemos fazer uma analogia do fluxo de elétrons com o fluxo de água em uma cascata conforme a figura D.4.
Figura D.4. Analogia de uma cascata com o fluxo de elétrons entre o ânodo e o cátodo. (Fonte: www.ufjf.br/nupis/files/2012/04/aula-2-eletroanal%C3%ADtica.pdf)

Nota
Células que estão operando para produzir energia elétrica são chamadas de células galvânicas. E as células que consomem energia elétrica são chamadas de células eletrolíticas.
O eletrodo da meia-célula da esquerda da figura D.3 é o eletrodo padrão contra o qual todos os demais eletrodos são comparados. É chamado de eletrodo de hidrogênio padrão ou normal e consiste em um pedaço de platina em folha recoberto eletroliticamente com negro de platina e imerso em uma solução de ácido clorídrico 1,184 M a 25°C. O hidrogênio gasoso à pressão de 1 bar é passado sobre a platina em folha através do tubo lateral e escapa através de pequenos furos no tubo de vidro circundante.
Nota
Por convenção, foi estabelecido que o potencial do eletrodo de hidrogênio padrão é igual a zero em todas as temperaturas.
Na célula eletroquímica da figura D.3, o hidrogênio é oxidado a H+ na meia cela da esquerda, liberando elétrons que se deslocam pelo condutor elétrico para a cela da direita e permitem a redução do íon Fe+3 a Fe+2. A reação global é dada pela equação D.1
Se um voltímetro fosse colocado no circuito entre os dois eletrodos, não haveria passagem de corrente mas o valor da diferença de potencial indicado seria uma medida da tendência das duas semi-reações acontecerem.
Nota
Se a atividade inicial de H+ , Fe+2 e Fe+3 for igual a 1 e a pressão de H2 for 1 atm, o potencial da célula(E) é chamado de potencial-padrão (Eθ).
Na semi-cela da esquerda a oxidação do hidrogênio tende a liberar elétrons para o eletrodo de platina criando um potencial negativo enquanto que na semi-cela da direita a redução do íon Fe+3 tende a retirar elétrons do eletrodo de platina criando um potencial positivo.
A diferença entre esses potenciais é uma medida da força motriz da reação global e seria de ~0,77 volts.
Retirando-se o voltímetro e fechando o circuito os elétrons fluiriam livremente da cela de hidrogênio para reduzir os íons Fe+3, reduzindo a concentração de íons Fe+3 e aumentando a concentração dos íons Fe+2. Mas ao se aproximar do ponto de equilíbrio haveria uma queda do fluxo de elétrons proporcional à concentração de íons Fe+3.
Se um voltímetro fosse novamente colocado no circuito entre os dois eletrodos, seria observado uma queda na diferença de potencial entre os dois eletrodos. Com o andamento da reação, a diferença de potencial entre os eletrodos chegaria a 0V, cessando a corrente elétrica.
Esse efeito da concentração no potencial pode ser calculado pela equação de Nernst (5). A equação de Nernst para a reação D.4 é:
Na maioria das aplicações a substituição de aFe+2 (atividade) por [Fe+3] (concentração molar) oferece uma exatidão aceitável.
Nota
A rigor, o uso da concentração molar no lugar da atividade só é válido para “soluções diluídas”. Com o aumento da concentração de eletrólitos aumenta também a diferença entre a atividade e a concentração molar.
O eletrodo de hidrogênio padrão é difícil de ser utilizado. Na prática, potenciais de eletrodos, na escala de hidrogênio, são usualmente determinados indiretamente usando um eletrodo de referência conveniente, cujo potencial em relação ao eletrodo de hidrogênio seja bem conhecido. Os eletrodos de referência geralmente usados são o eletrodo de prata-cloreto de prata e o de calomelano.
Fontes: Vogel - Análise Inorgânica Quantitativa, 1981 e Eletrodo de hidrogênio - O que há nos livros didáticos além de Eθ = 0?
Para se determinar a diferença de potencial entre um eletrodo e uma solução, é necessário haver um outro eletrodo e solução cuja diferença de potencial seja exatamente conhecida. Os dois eletrodos podem, então, ser combinados para formar uma pilha voltaica cuja força eletromotriz (fem ou emf) pode ser medida diretamente.
A fem da pilha é a soma aritmética, ou a diferença, das tensões dos eletrodos (dependendo dos sinais desses dois potenciais); o valor do potencial desconhecido pode ser, então, calculado.
O eletrodo de referência primário é o eletrodo de hidrogênio padrão, ou normal. O qual consiste em um pedaço de platina em folha recoberto eletroliticamente com negro de platina e imerso em uma solução de ácido clorídrico (HCl) contendo íons hidrogênio com atividade (Thermodynamic activity e Activity coefficient unitária (isto corresponde a ácido clorídrico 1,184 M a 25°C); o hidrogênio gasoso à pressão de 1 bar é borbulhado sobre a platina em folha em dois tipos de arranjos (A e B, figura D.5).
Figura D.5. Tipos de eletrodos de hidrogênio - (A) eletrodo tipo Hildebrand, (B) eletrodo com entrada de gás pela parte inferior. (Fonte: Eletrodo de hidrogênio - O que há nos livros didáticos além de Eθ = 0?)
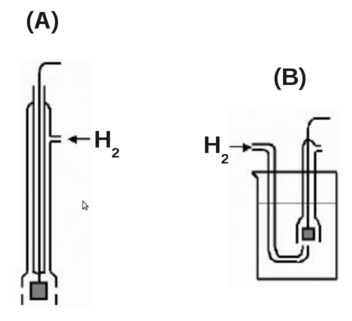
No eletrodo tipo Hildebrand (A) a formação periódica de bolhas provoca a flutuação do nível do líquido dentro do tubo, de modo que um parte da folha é, alternadamente, exposta à solução e ao hidrogênio. A parte inferior da folha de platina fica permanentemente imersa na solução, para se evitar a interrupção da corrente elétrica.
O negro de platina tem a propriedade importante de adsorver grandes quantidades de hidrogênio e permite a mudança da forma gasosa na iônica, bem como o processo inverso, sem obstáculos. Ele se comporta, então, como se fosse inteiramente composto de hidrogênio, ou seja, como um eletrodo de hidrogênio.
Sob condições fixas e estabelecidas (gás hidrogênio à pressão de 1 bar e íons hidrogênio com atividade unitária na solução em contato com o eletrodo) o eletrodo de hidrogênio possui um potencial definido. Por convenção, foi estabelecido que o potencial do eletrodo de hidrogênio padrão é igual a “zero” em todas as temperaturas.
Fazendo a conexão do eletrodo de hidrogênio padrão a um eletrodo metálico (um metal em contato com uma solução de seus íons em atividade igual à unidade), por meio de uma ponte salina (de, por exemplo, cloreto de potássio), pode-se determinar o valor do potencial de eletrodo padrão (Ver figura D.3)
A célula é geralmente escrita como:
Neste esquema, a barra vertical simples “|” representa a fronteira metal|eletrólito, onde se mede a diferença de potencial. A linha vertical dupla “||” representa a junção líquida, cujo potencial se despreza ou se considera como eliminado pela ponte salina.
Nota
Por convenção, o ânodo e a informação sobre a solução que está em contato com ele sempre são escritos à esquerda.
Como o potencial de uma célula depende das atividades dos componentes da célula, é prática comum indicar os dados de atividade ou de concentração dos constituintes da célula entre parênteses.
Quando se fala do potencial de eletrodo de um eletrodo de zinco, está se referindo à fem da célula:
ou a fem do eletrodo Zn+2|Zn.
E a reação da célula é:
e a reação do eletrodo
O potencial do eletrodo Fe+3, Fe+2 | Pt é a fem da célula
ou a fem do eletrodo Fe+3, Fe+2 |Pt.
E a reação da célula é:
E a reação do eletrodo é:
As reações de eletrodo são escritas, por convenção, como reações de redução:
M+n + ne- ⇆ M
Zn+2 + 2e- ⇆ Zn (Eθ = -0,763)
Fe+2 + 2e- ⇆ Fe (Eθ = -0,440)
2H+ + 2e- ⇆ H2 (Eθ = 0,000)
Cu+2 + 2e- ⇆ Cu (Eθ = +0,337)
Quando a atividade do íon M+n é igual à unidade (aproximadamente verdadeiro para uma solução 1M), o potencial de eletrodo E é igual ao potencial padrão Eθ. Existem tabelas de potenciais de eletrodo padrões em solução aquosa com referência ao eletrodo de hidrogênio padrão disponíveis na Internet (Ex: Wikipedia).
Quando os metais são ordenados segundo os valores dos seus potenciais de eletrodo padrões, obtém-se a chamada série eletroquímica dos metais.
Nota
Quanto maior é o valor negativo do potencial, maior é a tendência do metal a passar para o estado iônico, ou seja, se oxidar e liberar elétrons para o circuito. Dessa forma, um metal normalmente deslocará da solução de seus sais (recebendo elétrons e sendo reduzido) qualquer outro metal que tenha um potencial menos negativo (ou mais positivo) na série eletromotriz.
Assim o magnésio (Mg), o alumínio (Al), o zinco (Zn) e o ferro (Fe) deslocarão o cobre das soluções de seus sais, e por sua vez, o cobre (Cu) deslocará a prata (Ag).
O potencial de eletrodo padrão é uma medida quantitativa da capacidade que tem um elemento como agente redutor em solução aquosa. Quanto mais negativo for o potencial do elemento, mais poderosa será a sua ação como redutor.
Nota
É importante observar que os valores de potenciais de eletrodos padrões estão relacionados com uma condição de equilíbrio (⇆) entre o eletrodo metálico e a solução. Potenciais determinados sob essas condições são frequentemente chamados de potenciais de eletrodo reversível e a equação de Nernst “só é aplicável nessas condições.”
Nem todos os valores de potenciais de eletrodo disponíveis nas tabelas foram obtidos experimentalmente. Muitos foram calculados a partir de estudos de equilíbrio de reações redox e dados termodinâmicos.
Links: Experimento didático
Fonte: Skoog, 2002
A escolha do sinal dos potenciais de eletrodos já gerou muita polêmica ao longo da história da eletroquímica. E em 1953, a União Internacional de Química Pura e Aplicada (IUPAC) tentou resolver essa controvérsia durante uma reunião em Estocolmo.
De acordo com a convenção da IUPAC, o termo potencial de eletrodo (ou mais exatamente potencial de eletrodo relativo) está reservado exclusivamente para semi-reações escritas como reduções.
E o sinal do potencial de eletrodo é determinado pelo sinal do eletrodo de interesse quando acoplado ao eletrodo-padrão de hidrogênio em uma célula galvânica.
Assim, um eletrodo de zinco (Zn) ou de cádmio (Cd) se comportará como o ânodo a partir do qual os elétrons fluem através do circuito externo até o eletrodo-padrão de hidrogênio.
Esses eletrodos metálicos são, portanto, os terminais negativos de tais células galvânicas e seus potenciais de eletrodos possuem sinais negativos (-):
Zn+2 + 2e- ⇆ Zn(s) Eθ = -0,763 V
Cd+2 + 2e- ⇆ Cd(s) Eθ = -0,403 V
O potencial do eletrodo de cobre (Cu), por outro lado, é dado com sinal positivo porque o cobre se comporta como cátodo na cela galvânica construída com esse eletrodo e o eletrodo de hidrogênio, ou seja, os elétrons vão do eletrodo de hidrogênio para o eletrodo de cobre através do circuito externo. E portanto os seus potenciais de eletrodos possuem sinais positivos (+):
Cu+2 + 2e- ⇆ Cu(s) Eθ = +0,337 V
Atenção
Repetindo: os potenciais de eletrodos e seus sinais se aplicamm a semi-reações escritas como reduções.
Dessa forma, os sinais das tabelas de potenciais de eletrodo padrões permitem prever se a reação de redução é ou não espontânea com relação ao eletrodo-padrão de hidrogênio.
Por exemplo, se o eletrodo de cobre assume o sinal positivo (+) em relação ao eletrodo de hidrogênio, significa que os elétrons irão se deslocar do eletrodo de hidrogênio para o eletrodo de cobre (lembrar que os elétrons se deslocam do polo negativo para o polo positivo), e neste caso irá ocorrer uma reação de redução dos íons cobre (Cu+2) da solução para cobre metálico, que irá se depositar sobre o eletrodo de cobre, conforme a figura D.6.
Figura D.6. Potencial padrão do eletrodo de cobre atuando como cátodo (onde ocorre a redução). (Fonte: http://www.mundoeducacao.com/quimica/potencialpadrao-reducao-das-pilhas.htm)
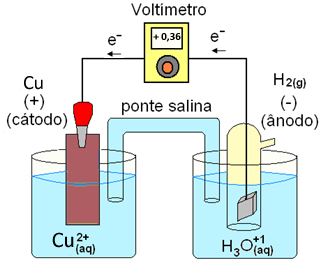
Por isso podemos dizer que a reação:
Cu+2 + H2(g) ⇆ 2H+ + Cu(s)
ocorre espontâneamente para a direita.
Por outro lado, o sinal negativo do potencial de eletrodo do zinco (-0,763 V) indica que os elétrons irão se deslocar do eletrodo de zinco para o eletrodo de hidrogênio, e neste caso irá ocorrer uma reação de oxidação do zinco metálico liberando íons zinco (Zn+2) para a solução conforme a figura D.7.
Figura D.7. Potencial padrão do eletrodo de zinco atuando como ânodo (onde ocorre a oxidação). (Fonte: http://www.mundoeducacao.com/quimica/potencialpadrao-reducao-das-pilhas.htm)
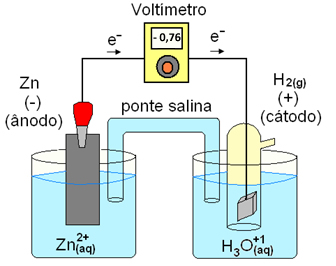
Por isso podemos dizer que a reação:
Zn+2 + H2(g) ⇆ 2H+ + Zn(s)
não ocorre espontâneamente para a direita.
Nota
Mas se for aplicado um potencial externo é possível “forçar” a reação no sentido da direita, e neste caso teremos uma célula eletrolítica e não mais uma célula galvânica.